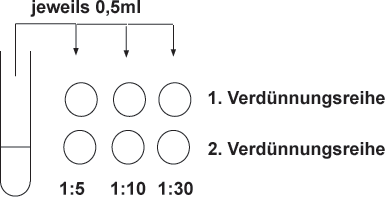
Voraussetzungen
Sie benötigen ein Photometer mit einem langwelligen Messbereich. Ausserdem benötigen Sie eine trübe Übernachtkultur von E. coli.
Zeitbedarf: Etwa 10 min für die Vorbereitung, falls zum Beispiel eine trübe Bakteriensuspension aus einem Züchtungs- oder Wachstumsexperiment vorhanden ist. Etwa 30 min für die Durchführung und die Auswertung des Experimentes.
Folgeexperimente: Sie können die Verdünnungsreihe ebenfalls nach diesen Angaben vermessen. Dabei sollten Sie für die Praxis zu dem so wichtigen Bezug zwischen OD und Zellzahl gelangen. Es ist nämlich möglich, aus der OD-Messung die Anzahl Bakterien pro ml zu bestimmen, ohne dass die Zellen im mikroskopischen Präparat ausgezählt werden.
Aufgaben
Legen Sie von einer trüben Bakteriensuspension zwei parallele Verdünnungsreihen an. Messen Sie die Optischen Dichten dieser Verdünnungsstufen und kalkulieren Sie die deltaE600nm der unverdünnten Bakterienkultur.
Lernziele
Sie lernen in diesem Versuch eine sehr schnelle und zuverlässige Methode kennen, das Wachstum einer Bakterienkultur zu verfolgen. Sie haben mit dieser Technik sogar die Möglichkeit, die Anzahl der Bakterienzellen, der Zellmasse und wichtiger andere Parameter zu bestimmen, ohne die Bakterien im mikroskopischem Präparat auszählen zu müssen. Die Technik wird weltweit von allen Mikrobiologen, Biotechnologen und Molekularbiologen angewendet.
Zusatzinformationen
Die Optische Dichtemessung ist eine Streulichtmessung bei langen Wellenlängen. Dabei werden kaum Zellinhaltsstoffe, sondern Partikel gemessen. Allerdings sollten diese Partikel "klein und punktförmig" sein.
Diese Voraussetzung trifft für Bakterienzellen mit einer Größe von etwa 1-2 µm näherungsweise zu. Dagegen sind Hefezellen mit durchschnittlich 10 µm Durchmesser wesentlich größer als Bakterien. Eine Optische Dichtemessung ist mit diesen eukaryotischen Zellen nicht praktikabel.
Die Optische Dichtemessung einer Bakteriensuspension beruht auf der Lichtstreuung an Partikeln. Bakterien sind Partikel mit einer von Wasser abweichenden Dichte. Diese Partikel verursachen eine Ablenkung langenwelligen Lichtes, wenn sie in einer Küvette in den Strahlengang eines Photometers gebracht werden. Das Licht wird durch diese Partikel also vom Detektor weggestreut. Ein solcher "Lichtverlust" wird als Extinktionswert im Filterphotometer bei 578 nm oder im Spektralphotometer bei 600 nm bestimmt.
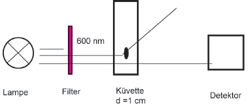
Abbildung 6: Prinzip der Streulichtmessung im Photometer. Dargestellt sind drei Lichtstrahlen: der obere hat eine Wellenlänge kleiner 600 nm, er wird im Filter absorbiert. Der mittlere Strahl wird an einem Bakterium in der Küvette gestreut. Der untere Strahl geht ungehindert durch das Messsystem, er wird im Detektor registriert.
Probleme
| Beobachtung | Lösung |
| Sie "messen" negative OD-Wert. | Sie ziehen einen falschen Leerwert von Ihrer Messprobe ab. Sie sollten niemals den "Leerwert" im Photometer auf "Null" setzen. |
| Sie messen stärker schwankende Werte, die bei der log-Auftragung der Messwert nicht auf einer Geraden liegen. | Achten Sie auf Ihre Verdünnungstechnik. Mischen Sie die Suspension gut auf einem Vortexer. Lassen Sie die Messproben einige Minuten im Photometer stehen, bis sich der oszillierende Messwert einem Endwert nähert. |
Sicherheit
Es sind keine besonderen Sicherheitsmassnahmen erforderlich, wenn Sie diesen Versuch mit plasmidfreien, gut definierten und nicht pathogenen Keimen durchführen.
Tipps und Hinweise
- Sie müssen dieses Experiment nicht unter Sterilbedingungen durchführen. Allerdings können Sie dieses Experiment dazu nutzen, steriles Arbeiten zu üben. Möchten Sie unter sterilen Bedingungen arbeiten, dann müssen alle Materialien mit Aussnahme der Plastikküvette sterilisiert worden sein.
- Lebensfähige Keime sind nicht unbedingt erforderlich. Sie können also auch eine "ältere" Kultur als Ausgangsmaterial verwenden.
- Prüfen Sie Ihre Plastikküvetten auf Fingerabdrück, Kratzer und sonstige Beschädigungen.
- Sie können alle Messungen in einer Küvette ausführen. Wenn Sie von hohen Verdünnungsstufen in aufsteigender Folge messen brauchen Sie die Küvette lediglich auf saugfähigem Haushaltswischtuch ausschlagen.
- Achten Sie darauf, dass keine Lösung außen an der Messfläche der Küvette entlangläuft. Wischen Sie solche Flüssigkeiten und Schmutzreste sofort mit einem weichen Haushaltswischtuch ab.
- Kennzeichnen Sie notfalls die Seite der Messfläche im oberen Bereich mit einem Eddingstift.
- Mustern Sie vor der Messung Ihre Küvette, ob Gasblasen oder Schmutzreste im Bereich der Messfläche zu sehen sind.
- Testen Sie mit einer Vollküvette und mit einer reduzierten Küvette die minimale Füllhöhe, die in Ihrem Photometer reproduzierbare Messwerte liefert. Merken Sie sich diese Volumina!
- Pipettieren Sie die Bakteriensuspensionen genau. Pipettieren Sie mindestens 100 µl Bakteriensuspension, wenn Sie eine kalibrierte variable Pipette besitzen. Kleinere Probenvolumina sollten vermieden werden.
- Pipettieren Sie 100 µl nach Möglichkeit mit einer variablen 200 µl-Pipette. Vermeiden Sie eine variable 1000 µl-Pipette.
- Verdünnen Sie Bakteriensuspensionen zur O.D.-Messung schon zu Beginn der Wachstumskurve mindestens 1:5. Notwendige Folgeverdünnungen sollten Sie in großen Schritten durchführen, um Verdünnungsfehler gering zu halten, also 1:5, dann 1:10 und 1:30.
- Diese Messtechnik ist nicht auf ein Wachstumsexperiment mit Hefen übertragbar. Für eine Erläuterung schauen Sie unter den Zusatzinformationen nach.
- Nutzen Sie einen Edding 3000. Kleinere Strichstärken haben sich im Labor nicht bewährt, da sie zu schnell unlesbar werden.
Fragen
- Welche Wellenlänge enthält das energiereichere Licht, 200 nm oder 600 nm?
- Was ist der Unterschied zwischen einer Streulicht- und einer Absorptionsmessung?
- Warum kann man nicht jede beliebe Trübung messen, inbesondere sehr trübe Suspensionen?