Transformation
Methode
Die Transformation verläuft nach folgenden Schritten:
- Herstellen kompetenter E. coli Zellen. (Eine einfache Alternativmethode finden Sie hier. Außerdem gibt es die Rubidiumchlorid-Methode und die Inuoe-Methode für ultrakompetente Zellen).
- Züchten Sie eine 2ml E.coli-Übernachtkultur in C-Medium.
- Überimpfen Sie 300 µl dieser Übernachtkultur in 3ml frisches, 37°C warmes C-Medium.
- Inkubieren Sie diesen Ansatz 20 Minuten bei 37°C auf einem Schüttler (250 Upm).
- Mischen Sie die T-Solution A mit der T-Solution B im Verhältnis 1:1 (0,5 ml A + 0,5 ml B = 1ml fertige Lösung, die für 4 Transformationen reicht). Halten Sie diese Lösung auf Eis.
- Zentrifugieren Sie 3 ml der Kultur aus Schritt 3 (1 min, 13000 x g, Raumtemperatur) in ein 2ml-Eppendorfreaktionsgefäß.
- Verwerfen Sie den Überstand und resuspendieren Sie den Zellniederschlag in 600 µl eisgekühlter T-Solution-Mischung (aus Schritt 5).
- Stellen Sie diese Zellen 5 min auf Eis. Zentrifugieren Sie die Zellen ab (1 min, 13000 x g, Raumtemperatur) und resuspendieren Sie den Zellniederschlag in 240 µl eiskalter T-Solution-Mischung. Inkubieren Sie diese Zellen 5 min auf Eis.
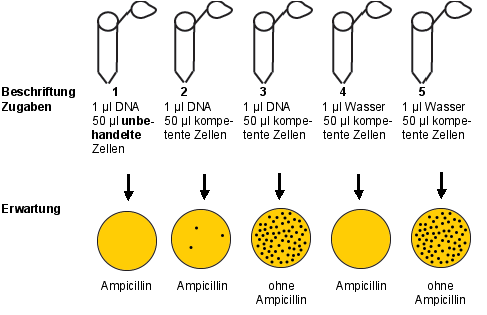
- Bereiten Sie 5 sterile Eppendorfgefäße vor: in Gefäße 1 , 2 und 3 geben Sie 1 µl Vectorlösung (10-100 pg), in Gefäß 4 und 5 jeweils 1 µl steriles Wasser. Kühlen Sie diese Gefäße 2 min auf Eis.
- Pipettieren Sie in die Eppendorfreaktionsgefäß 2-5 jeweils 50 µl Zellsuspension aus Schritt 7. In das Eppendorfgefäß 1 geben Sie 50 µl einer "normalen", unbehandelten Kultur.
- Stellen Sie diese Ansätze 5 min auf Eis.
- Streichen Sie mit dem Drigalskispatel jeweils einen kompletten Ansatz auf eine beschriftete Agarplatte aus, die bei 37°C vorgewärmte wurde :
- LB, amp plus DNA (unbehandelte Kultur)
- LB, amp plus DNA (aus Gefäße 2 im Schritt 9)
- LB, ohne amp, plus DNA (aus Gefäß 3 im Schritt 9)
- LB, amp plus Wasser (aus Gefäß 4 im Schritt 9)
- LB, ohne amp plus Wasser (aus Gefäß 5 im Schritt 9)
- Inkubieren Sie diese Agarplatten bei 37°C über Nacht.
- Auswertung:
- Zählen Sie die Kolonien auf den einzelnen Agarplatten.
- Berechnen Sie die Transformationseffizienz aus den auf amp-haltigen Agarplatten gewachsenen Kolonien (Ansatz 1, Schritt 12) dividiert durch die zugegebene Plasmidmenge. Diese Rechnung ergibt x Transformanden/µg Plasmid-DNA.
- Bestimmen Sie die Transformationsfrequenz. Bilden Sie dafür den Quotienten aus den Kolonien, die auf amp-haltigen Agarplatten und den Kolonien, die auf amp-freien Agarplatten gewachsen sind.
- Überprüfen Sie den Plasmidgehalt der Transformanden: entweder durch die schnelle cracking-Methode oder durch eine Plasmid-Isolierung.