Voraussetzungen
Sie benötigen ein Photometer, mit dem Sie bei Wellenlängen von 340 oder 365 nm messen können. Sie benötigen außerdem Biochemikalien, die Sie in der Regel bei minus 20°C lagern müssen.
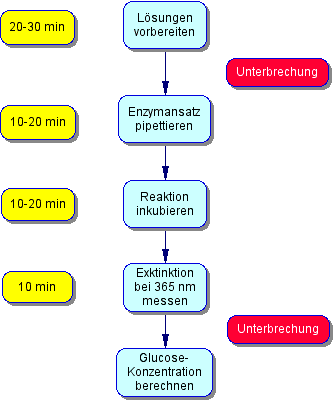
Zeitbedarf: Für das Ansetzen der Lösungen benötigen Sie etwa 20-30 Minuten Zeit. Sie können dann das Experiment unterbrechen. Von der Anzahl mehrere Messungen hängt der zusätzlich Zeitbedarf ab: Sie werden bei ca. 6 parallelen Messungen weitere 20-30 Minuten benötigen. Von dieser Zeit beansprucht die Inkubationszeit den größten Anteil.
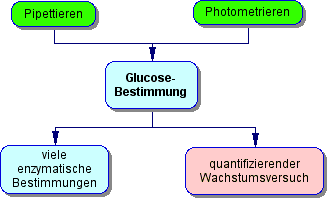
Folgeexperimente: Sie können Wachstumsexperimente mit Glucose als Kohlenstoff- und Energiequelle quantifizieren. Damit erschliesen Sie sich eine wichtige biotechnologische Messgröße. Das Messprinzip des "gekoppelten enzymatischen Tests" lässt sich auf enzymatische Bestimmungsmethoden vieler anderer Substrate übertragen.
Aufgaben
- Messen Sie in einem enzymatischen Test die Glucosekonzentration verschiedener glucosehaltiger Lösung (Glucose-Stammlösung, Traubenzucker, verdünnter Honig, aufgelöste Schockolade, Erfrischungsgetränke, etc).
- Kontrollieren Sie die Spezifität der Reaktion, in dem Sie andere Zucker (z.B. Fructose, Lactose, Mannose, etc.) mit diesem Ansatz zu bestimmen versuchen.
- Kontrollieren Sie die Abhängigkeit der Reaktion von Testbedingungen wie der Temperatur und der Mg2+-Konzentration.
Lernziele
In diesem Experiment lernen Sie eine spezifische und schnelle enzymatische Bestimmung kennen. Das Prinzip dieser Messung ist aus dem Stoffwechsel der Glucose abgeleitet. Sie werden durch diesen Test in die Lage versetzt, Wachstumsversuche zu quantifizieren und das Messprinzip auf andere enzymatische Bestimmungsmethoden zu übertragen.
Probleme
| Beobachtung | Lösungsansatz |
| Es ist keine Reaktion erkennbar (keine NADPH-Zunahme messbar). | Haben Sie den richtigen pH-Wert in der Küvette vorliegen? Haben Sie NADP als Coenzym vorgelegt? Haben Sie Mg2+ im Test? Sind Ihre Biochemikalienlösungen frisch angesetzt? |
| Die Reaktion (NADPH-Zunahme) verläuft sehr langsam. | Sind alle Substrate in den angegebenen Konzentrationen im Testansatz vorhanden? Messen Sie bei 37°C? Geben Sie von der Glucose-Stammlösung in den Ansatz und messen Sie die Extinktionszunahme. Messen Sie eine Probe ausschließlich mit definierten Lösungen (keinen Ansatz aus einer Lebensmittelprobe). |
| Bei gleichen Proben erhalte ich unterschiedliche Extinktionswerte am Ende der Reaktion. | Arbeiten Ihre Pipetten genau? Sind Sie sicher, gleiche Volumina und damit gleiche Konzentrationen pipettiert zu haben? Haben Sie Ihre Lösungen und Proben aus homogenisierten Medien entnommen? Haben Sie mit einer komplexen Probenmatrix eine NADPH-abbauende Aktivität in den Test gebracht? |
Sicherheit
In diesem Versuch ist kein Gefährdungspotenzial erkennbar. Viele Substanzen sind Biochemikalien, die auch in unserem Körper vorkommen.
| Tabelle 1: Sicherheitsdatenblätter als pdf-Dateien | |
| Abkürzungen, Gefahrensymbole, R+S-Sätze | 100 KB |
| Hexokinase-Glucose-6-Phophat Dehydrogenase | 33 KB |
| NADP | 20 KB |
Tipps und Hinweise
- Setzen Sie quantitative enzymatische Teste immer in 1ml-Geamtvolumina an. Sie können dann wesentlich leichter in Konzentrationen umrechnen.
- Abgesehen von der Probelösung, kann die Konzentration der anderen Testkomponenten in Grenzen schwanken. Sie sind in der Regel überschüssig im Test vorhanden.
- Messen Sie keine Extinktionswerte, die über E=1,5 - 2,0 hinausgehen. Auch bei "guten" Photometern verlassen Sie je nach Wellenlänge und Lampentechnologie deren linearen Messbereich.
- Gekühlte Biochemikalien-Vorräte sollten Sie vor dem Öffnen unbedingt in der Hand anwärmen. Sonst nehmen sie Wasser aus der Luft auf, was zum beschleunigten Zerfall der Substanzen beiträgt.
- Setzen Sie die Testkomponenten in einzelnen Stammlösungen an, damit Sie mehr Variations- und Testmöglichkeiten haben. Setzen sie nur soviel an, wie Sie vermutlich in einem Tag verbrauchen werden.
- Lösungen von Biochemikalien sollten während der Messungen auf Eis aufbewahrt werden. Eisgekühlte Enzym-Lösungen reagieren wesentlich langsamer, als bei Raumtemperatur oder gar bei 37°C.
- Achten Sie unbedingt darauf, dass Portionen aus diesen Stammlösungen nur mit sauberen Pipettenspitzen entnommen werden.
- Halten Sie die Pufferkomponente, als den größten Volumenanteil des Testes, bei Raumtemperatur. Damit verhindern Sie lange Temperaturausgleichszeiten in der Inkubationseinheit. Gekühlte Lösungen können auch zu beschlagenen Küvetten führen, die dann zu Messfehlern beitragen können.
- Kalibrieren Sie zu kritischen Bestimmungen die verwendeten Pipetten, ob die eingestellten Volumina auch korrekt abgegeben werden. Berechnen Sie den Fehler, wenn die pipettierten Volumina um 10, 20 oder 30 µl abweichen.
- Wenn Sie schnell mehrere Proben nebeneinander messen möchten, dann können Sie in einer Endpunktbestimmung die Ansätze in beschriftete Eppendorfreaktionsgefäße pipettieren und bei 37°C für 20 min inkubieren.
- Messen Sie die Extinktion nach 0 bzw. nach 15 und 20 min. Sollten die Extinktionswerte nach 20 min gegenüber den Werten nach 15 min wesentlich gestiegen sein, dann verlängern Sie die gesamte Inkubationsphase.
- Wenn Sie kein registriendes Photometer zur Verfügung haben, das Ihnen kontinuierlich die Messwerte einer Probe aufzeichnet, so können Sie den Reaktionsverlauf dennoch verfolgen, in dem Sie z.B. alle 30 sec einen Messwert ablesen und diese Messwert mit einem Graphikprogramm darstellen.
Fragen
- Wo spielen Glucosebestimmungen eine wichtige Rolle?
- Welche alternativen Glucosebestimmungen kennen Sie?
- Wie spezifisch ist die Hexokinasereaktion?
- Wie könnten Sie mit einem leicht abgewandelten Testansatz andere Hexosen (C6-Zucker) bestimmen?
- Warum brauchen Sie bei enzymatischen Bestimmungen auf Basis der NAD/NADH- bzw. der NADP/NADPH-Messung keine Kalibrierkurve aufzunehmen?
- Wie hoch ist die Magnesiumkonzentration im Testansatz?
- Wie groß ist Ihr Pipettierfehler, wenn Sie tatsächlich 1010 µl messen, anstatt der theoretisch vorhandenen 1000 µl?