Voraussetzungen
Dieses Experiment ist einfach angelegt, damit jeder die Vermehrung des Mikroorganismus lernen kann. Sie sollten die Grundtechniken mikrobiologischer Arbeiten kennen: autoklavieren, kultivieren, sterilfiltrieren und eventuell auch photometrieren und messen der Optischen Dichte.
Zeitbedarf: Für dieses Experiment sind etwa 30 min für die Vorbereitungen, etwa 2-3 Stunden für das Autoklavieren und eine Nacht für die Bebrütung einzuplanen.
Folgeexperimente: Als Folgeexperimente können eine Verdünnungsreihe, ein Wachstumsexperiment unter aeroben Bedingungen, eine Reihenuntersuchung an Plasmiden oder auch eine Plasmidisolierung durchgeführt werden.
Aufgabe
- Bereiten Sie ein Komplexmedium vor.
- Portionieren Sie dieses Medium zu 5 ml Fraktionen in 20 ml-Reagenzgläser.
- Autoklavieren Sie dieses Medium.
- Geben Sie E. coli oder Bacillus subtilis hinzu.
- Bebrüten Sie das Medium bei 37°C oder bei Raumtemperatur über Nacht.
- Beobachten Sie die Trübung.
Lernziele
Sie lernen eine einfache Methode zur Vermehrung von Mikroorganismen kennen. Diese Technik wird Sie in die Lage versetzen, viele andere Organismen nach gleichem Schema zu vermehren. Damit haben Sie sich den Zugang zu vielen biologischen Experimenten eröffnet.
Probleme
| Beobachtung | Lösungsansatz |
| Kein Gefäß ist trübe geworden. | War Ihre Starterkultur lebensfähig? |
| Alle Gefäße sind trübe geworden. | Haben Sie unsteril gearbeitet? Haben sie vergessen, das Antibiotikum zuzugeben? Haben Sie mit einem plasmidhaltigen Stamm gearbeitet? |
| Alle Gefäße mit Ausnahme des antibiotikahaltigen Mediums sind trübe geworden. | Vermutlich haben Sie unsteril gearbeitet. Das Antibiotikum verhindert das Wachstum der Kontaminanten. |
Sicherheit
Verwenden Sie nur definierte Bakterienstämme der Sicherheitsstufe 1!
Achten Sie auf steriles Arbeiten. Lassen Sie sich von einem Experten in die mikrobiologischen Techniken einführen.
Unter solchen Bedingungen ist keine Gefahr für den Experimentator oder die Umwelt zu erwarten. Bevor Sie mit Schülern ein mikrobiologisches Experiment zum erstenmal durchführen, sollten Sie ihnen eine Einweisung in die Arbeitstechniken geben.
Tipps und Hinweise
- Schneller lernen Sie, wenn Sie sich von einem Fachmann die Handgriffe zeigen lassen. Er wird Ihnen auch weitergehende Erklärungen geben können, warum etwas in der beschriebenen Weise durchgeführt wird. Behilflich sind NUGI und seine erfahrenen Fachlehrer.
- Beschaffen Sie sich möglichst Flüssigmedien, die Sie bei Bedarf durch hinzufügen von Agar-Agar verfestigen können. Sie bekommen durch diese beiden Kompenenten mehr experimentelle Flexibilität.
- Beschaffen Sie sich für den Beginn einfache Komplexmedien, wie sie unter Material aufgeführt werden. Diese Medien erleichtern Ihnen das Arbeiten und verkürzen die Vorbereitungszeiten.
- Beschaffen Sie sich gleich größere Mengen Medien (z.B. 500 g Packungen), wenn Sie gedenken mehrere Versuche über längere Zeit durchzuführen.
- Haben Sie kein demineralisiertes Wasser, so können Sie auch mit Leitungswasser einen Versuch unternehmen. Haben Sie keine Alu-Kappen, so können Sie auch festere Alu-Folie zum verschließen der Gefäße verwenden.
- Haben Sie keinen Autoklaven, so kann auch ein Schnellkochtopf in Erwägung gezogen werden. Füllen Sie den Schnellkochtopf mit 800 ml Wasser und betreiebn Sie ihn 45 min unter Kochbedingungen. Allerdings werden in diesem System keine 121°C erreicht. Auch die Gefährung durch Siedeverzüge ist beträchtlich!
- Setzen Sie das Medium im erforderlichen Gesamtvolumen in einem Plastikbecher an und verteilen Sie dann die 5ml-Portionen mit einer Dosierpipette auf die erforderliche Anzahl 20ml-Reagenzgläser.
- Vermeiden Sie mehr als 5 ml Medium in die Reagenzgläser einzufüllen. Die Sauerstoffversorgung der wachsenden Kultur wird bei größerem Volumen schlechter. Siehe auch den Versuch zum Sauerstoffverbrauch einer Bakterienkultur.
- Falls Sie eine Inkubationseinheit besitzen, so sollten Sie den Schüttler auf möglichst hohe Schüttelgeschwindigkeit einstellen: mindestens 200 Upm. Damit vermeiden Sie Sauerstoffmangel in der Kultur.
- Je größer das Inokulum ist, desto schneller können Sie die Trübung der Kultur beobachten. Verwenden Sie bis zu 10% einer ausgewachsenen Vorkultur, d.h. auf 20ml Medium wird bis zu 2 ml Inokulum zugegeben.
Fragen
- Wie erklären Sie die Trübung?
- Welchen Zusammenhang vermuten Sie zwischen der Trübung und der Anzahl der Bakterien in dieser Flüssigkeit?
- Wieviele Bakterien pro Milliliter erwarten Sie in einer "trüben" Kultur?
- Können Sie sicher sein, dass eine nicht eingetrübte Kultur keimfrei ist?
- Welchen Rückschluss ziehen Sie z.B. für Lebensmittelbetriebe, pharmazeutische Betriebe oder ihrer persönliche Hygiene aus Ihrem Experiment?
- Sind ihre E. coli Zellen mit oder ohne Sauerstoff gewachsen?
- Dürfen Sie die antibiotikahaltigen Medien nach dem Autoklavieren in den Abguss entleeren, oder bringen Sie damit Antibiotika in die Umwelt, mit der Gefahr einer erhöhten AB-Resistenzbildung?
- Sie haben keine Möglichkeit, die benutzten Kulturgefäße nach dem Experiment durch Hitze zu inaktivieren. Sie nehmen eine chemische Sterilisierung vor. Dürfen Sie dann die antibiotikahaltigen Medien gefahrlos im Abguss entsorgen?
Zusatzinformationen
Warum werden Mikroorganismen in vielen Bereichen bevorzugt eingesetzt?
Sie sind häufig leicht zu züchten und sie wachsen schnell. Warum können Sie schnell wachsen? Weil sie "klein" sind. In diesem Fall gilt "small is beautiful", weil kleine Organismen eine vergleichsweise große Oberfläche zum Volumen besitzen und somit schnell viele Nährstoffe (auch Sauerstoff) aufnehmen können.
Hier einige Graphiken, die ihnen diese Zusammenhänge am Beispiel eines kugel- und eines zylinderförmigen Körpers veranschaulichen. Die Kugel- und die Zylinderform sind die beiden vorherrschenden Körperformen bei Bakterien. Die "Standardgröße" vieler Bakterien beträgt 1 bis 2 µm. Tatsächlich finden sich Körperlängen zwischen 0,5 und über 800 µm.
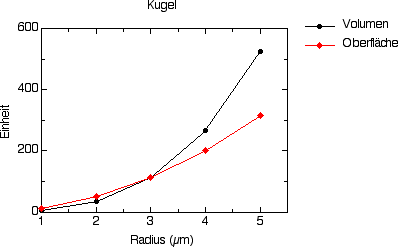
Abbildung 1: Beziehung zwischen Oberfläche und Volumen einer Kugel in Abhängigkeit ihres Radius.
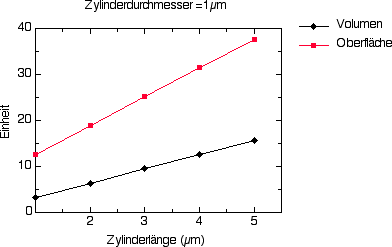
Abbildung 2: Beziehung zwischen Oberfläche und Volumen eines Zylinders mit einem Zylinderdurchmesser von 1 µm in Abhängigkeit der zunehmenden Zylinderlänge ("länger werdende Stäbchen").
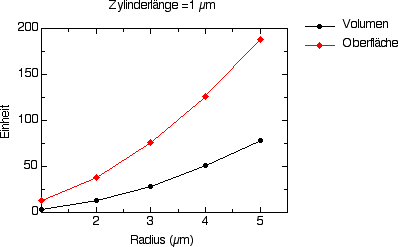
Abbildung 3: Beziehung zwischen Oberfläche und Volumen eines Zylinders mit einer konstanten Zylinderlänge von 1 µm in Abhängigkeit eines zunehmenden Zylinderradius ("dicker werdende Stäbchen").
Überprüfen Sie diese theoretischen Aussagen an dem folgenden elektronenmikrospoischen Bild einer Kariesplaque, einem Biofilm aus vielen verschiedenen Bakterienarten auf Zähnen.

Abbildung 4: Elektronenmikroskopische Aufnahme (Rastermikroskop) einer Kariesplaque auf einem menschlichen Zahn.
