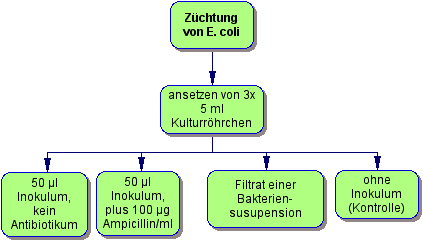
Züchtung
Methode
Wiegen Sie für 100 ml Medium (entspricht 20 Kulturansätze zu je 5 ml)
- 2 g LB-Bouillon (Lennox) in den Plastikbecher ein,
- geben Sie 100 ml demineralisiertes Wasser (notfalls auch Leitungswasser) hinzu,
- rühren Sie die Lösung, bis die Medienbestandteile vollständig gelöst sind,
- messen Sie zur Kontrolle den pH-Wert dieser Lösung (pH 7±0,2),
- verteilen Sie das Medium mit dem Handdispenser in 5 ml Portionen auf die Reagenzgläser,
- verschließen Sie diese Reagenzgläser mit den Alu-Kappen und autoklavieren Sie die Ansätze.
Nach dem Autoklavieren kühlen Sie die Kulturgefäße auf Raumtemperatur ab. Stellen Sie vier sterile Kulturgefäße im Reagenzglasständer auf (Bild). Das vierte Gefäß wird nicht beimpft; es dient als Kontrolle. In das zweite Kulturgefäß geben Sie das Sterilfiltrat ihrer Bakterienkultur. In das dritte Reagenzglas geben Sie 5 µl der Ampicillinstammlösung (ergibt 100 µg Ampicillin/ml Kultur). Beimpfen Sie aus einer Vorkultur die beiden rechten Gefäße mit einer Impföse oder geben Sie 50 µl der Vorkultur mit einer sterilen Spitze an der Eppendorfpipette zu.
Beschriften Sie ihre Kulturgefäße und inkubieren Sie die Ansätze über Nacht auf dem Schüttelinkubator, für ein bis zwei Tage stehend im Brutschrank bei37°C oder bei Raumtemperatur.
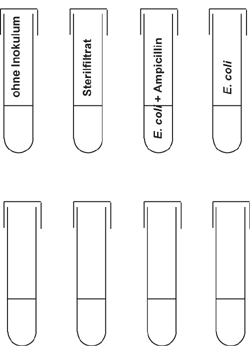
Abbildung 2: Versuchsansatz zum Züchtungsexperiment mit 4 Kulturröhrchen. Tragen Sie in die untere Reihe das Versuchsergebnis ein, wie Sie es erwarten. Schwärzen Sie die Fläche, wenn Sie Wachstum erwarten; punktieren Sie die Fläche, wenn nur geringes Wachstum erwartet wird.
Tragen Sie Ihre Erwartung zum Ergebnis in die obige Skizze ein und begründen Sie Ihre Erklärung. Tragen Sie nach der Inkubation Ihr Ergebnis in die zweite Reihe darunter ein. Vergleichen Sie dann die Übereinstimmungen und diskutieren Sie die Abweichungen.
Autoklavieren Sie abschließend alle ihre benutzten Kulturgefäße und entsorgen Sie die Lösungen dann im Ausguss.